Amonjaka strūklaka. E
Eksperimenta mērķis: iegūt amonjaku un novērot tā šķīdību ūdenī.
Nepieciešams: 1
- Amonija hlorīds;
- Kalcija hidroksīds;
- Sālsskābe;
- Destilēts ūdens;
- Universālais indikators, 5 pilieni;
- Lakmusa papīrs;
- Kristalizators;
- Statīvs;
- Statīva gredzens;
- Apaļkolba, 500ml;
- Apaļkolbas aizbāznis;
- Apaļkolbas aizbāznis ar diviem kakliem;
- Novadcaurulīte;
- Nūjiņa, vielu maisījuma samaisīšanai;
Darba gaita: 2
Sausā amonjaka sagatavošana un uzkrāšana
- Uzstāda gāzes uzkrāšanas iekārtu, kā parādīt attēlā:
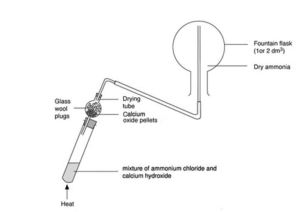 Avots: https://edu.rsc.org/resources/ammonia-fountain-experiment/979.article
Avots: https://edu.rsc.org/resources/ammonia-fountain-experiment/979.article - Ievieto mēģenē amonija hlorīdu un kalcija hidroksīdu, noslēdz ar aizbāzni un pievieno klāt gāzes uzkrāšanas iekārtai.
- Silda nedaudz mēģeni, līdz vielu maisījums sāk sadalīties un izdalās gāze.
- Pietuvina universālidikatora papīrīti pie apaļkolbas, lai pārliecinātos, vai ir uzkrāts amonjaks, jāiekrāsojas tumši zilā krāsā. Ja ir nepieciešams turpina sildīt mēģeni ar vielu maisījumu.
- Noslēdz apaļkolbu ar aizbāzni.
Amonjaka strūklaka:
- Izveido nepieciešamo iekārtu, kā rādīts attēlā:
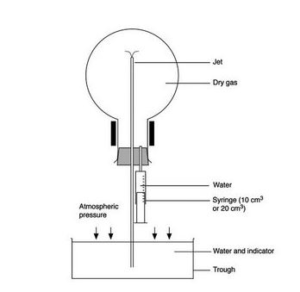 Avots: https://edu.rsc.org/resources/ammonia-fountain-experiment/979.article
Avots: https://edu.rsc.org/resources/ammonia-fountain-experiment/979.article - Ielej kristalizatorā destilētu ūdeni, pievieno klāt universālindikatoru un atšķaidītu sālsskābi.
- Uzpilda šļirci ar 20 ml ūdeni un pievieno to klāt aizbāznim.
- Ievieto gāzu novadcaurulīti kristalizatorā un pievieno klāt aizbāznim.
- Strauji samaina apļkolbas aizbāzņus, pievieno klāt aizbāzni ar šļirci un novadcaurulīti.
- Saspiež šļirci un iepilina tās saturu apaļkolbā, kurā ir uzkrāts amonjaks.
- Izšķīstot gāzei, apaļkolbā veidojas pazemināts spiediens un pa ievadcaurulīti tiek iesūkts ūdens, kas ceļās augšup un saskarē ar amonjaku maina krāsu, veidojas strūklaka.
Metodiskās norādes: 3
Teorētiskais pamatojums
Sildot, mēģenē notiek ķīmiska reakcija. Viens no reakcijas produktiem ir amonjaks, bezkrāsaina gāze ar specifisku asa smarža.
(NH4)2CO3 + Ca(OH)2 → 2NH3+ CaCO3 + 2H2O
Amonija karbonāts un kalcija hidroksīds nereaģē ļoti labi viens ar otru. Sildot līdz 60°C, amonija karbonāts sadalās trīs gāzveida vielās:
(NH4)2CO3 → 2NH3+ CO2 + H2O
Atbrīvotais oglekļa dioksīds absorbē kalcija hidroksīds:
Ca(OH)2 + CO2 → CaCO3+ H2O
Abi šie procesi notiek vienlaicīgi un līdz ar to tiek iegūt gāzveida amonjaks, kas uzkrājas apaļkolbā.
Amonjaks labi šķīst ūdenī. Daļa amonjaka ātri izšķīst ūdens piliena veidā novadcaurulītes galā. Tā rezultātā spiediens kolbā samazinās un ūdens ieplūst spiediena atšķirību dēļ, salīdzinot ar atmosfēras spiedienu.
NH3 + H2O⇌ NH4++ OH–
Šķīdumu sāraminu padara OH – jonu klātbūtne. (Pēc https://edu.rsc.org/resources/ammonia-fountain-experiment/979.article)
Video var redzēt līdzīgi veiktu eksperimentu, kurā amonjaku iegūst no koncentrēta amonjaka šķīduma. Video saite: https://www.youtube.com/watch?v=X1BktOPsc7g&list=PLE_meO4B9L02-9OYGCY8XOYk0DrhHrV31&index=11
Eksperimentu pievienoja: Ilze Seglēre, Latvijas Universitāte “Dabaszinātņu un IT pedagogs”.

