Ziepju šķīduma īpašības E
Eksperimentu skolēni veic kā laboratorijas darbu tematā “Sadzīvē izmantojamās vielas un materiāli”. Mērķis: pārbaudīt ziepju šķīduma īpašības.
Nepieciešams: 1
- Ziepes, ~2 g,
- sālsskābes, 6M,
- minerālūdens ar augstu kalcija jonu koncentrāciju, vismaz 200 mg/L,
- piesātināts nātrija hlorīda šķīdums, 5 mL,
- destilēts (vai dejonizēts) ūdens, 30mL,
- vārglāze, 50 mL,
- mēģene ar aizbāzni, 4. gab. ,
- stikla nūjiņa,
- mēģeņu statīvs,
- elektriskā plītiņa.
Darba gaita: 2
- Sasmalcina ar skalpeli 0,2 g ziepju un ievieto tās vārglāzē, sildot un maisot, pilnīgi izšķīdina 20 mL destilēta ūdens.
- Atdzesē iegūto šķīdumu.
- Ielej četrās mēģenēs ~5 mL iegūtā šķīduma.
- Pievieno 1. mēģenē 5 pilienus 6 M HCl. Novēro izmaiņas.
- Pieliec slīpi 2. mēģeni un tajā uzmanīgi gar sieniņu ar pipeti ielej 5 mL piesātināta nātrija hlorīda šķīduma. Novēro izmaiņas.
- Ielej 3. mēģenē 5 mL minerālūdens. Novēro izmaiņas.
- Pievieno 5 mL destilēta ūdens 4. mēģene.
- Noslēdz mēģeni un spēcīgi sakrata. Novēro putu veidošanos.
Metodiskās norādes: 3
Novēro
1.mēģene. Šķīdumā sākumā veidojas duļķojums, vēlāk – nogulsnes. Pats šķīdums kļūst ievērojami dzidrāks.
2.mēģene. Uz ziepju šķīduma un NaCl šķīduma robežvirsmas veidojas baltas, biezas nogulsnes. Pēc tam šķīdumu var lēnām samaisīt ar stikla nūjiņu. Šķīdums kļūst daudz dzidrāks, bet ziepes veido nogulsnes.
3.mēģene. Šķīdums kļūst pienbalts, un tajā ir redzamas sīkas nogulsnes. Ja mēģeni noslēdz ar aizbāzni un spēcīgi sakrata, redzams, ka šķīdums neputo.
Drošība
6 M sālsskābe ir kodīga. Strādājot ar to, jāizmanto aizsargbrilles.
Pēc eksperimenta pārruna ziepju īpašības cietā ūdenī, skābā vidē un koncentrētos sāļu šķīdumos (izsālīšana). Kādas problēmas tādēļ rodas, mazgāšanai izmantojot ziepes?
Teorētiskais pamatojums
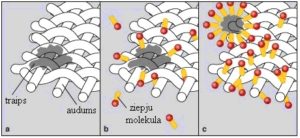
Ziepes ir augstāko karbonskābju sāļi un tās iegūst, pārziepojot taukus. Atbilstošo karbonskābju nātrija sāļi veido cietās ziepes, bet kālija sāļi – šķidrās ziepes. Ziepes tāpat kā citi mazgāšanas līdzekļi ir virsmaktīvas vielas un tām piemīt mazgājoša darbība.
Ziepju molekulām ir divejāda daba. Ziepju molekulas “galvai” ir jonu īpašības un tā viegli šķīst ūdenī, bet garajai “astei” (ogļūdeņraža atlikumam) piemīt spēja šķīst eļļā (taukos). Mijiedarbojoties ar netīrumiem, ziepju molekula izmanto savu divejādo dabu. Ziepju molekulas “aste” šķīst eļļā un sašķeļ eļļas pilienu mazākos pilieniņos, kas disperģē šķidrumā. Šos pilieniņus apņem hidratētas ziepju molekulas, neļaujot tiem apvienoties. Ziepju molekulu adsorbcijas dēļ starp virsmu un netīrumu daļiņām sāk darboties atgrūšanās spēki, kas nodrošina daļiņu atdalīšanos no virsmas.
Ziepes zaudē savas mazgājošās īpašības cietā un skābā ūdenī.
Cietā ūdenī ir Ca2+ un Mg2+ joni. Ziepes reaģē ar šiem joniem un veido ūdenī nešķīstošus karbonskābju sāļus. Tāpēc daļa ziepju nogulsnējas.
2C17H35COONa+Ca2+→(C17H35COO)2Ca↓+2Na+
Skābā ūdenī ir H+ joni. Ziepes ar šiem joniem stājas apmaiņas reakcijā, izgulsnējot karbonskābi.
C15H31COONa+H+→C15H31COOH +Na+
(Pēc: Namsone. D.Organiskā Ķīmija vidusskolai . Rīga. Zvaigzne ABC. 1998. 283 – 286. lpp.)
Sagatavoja: Kristīne Juhņeviča, e-pasts kristine.juhnevica@lu.lv
Adaptēts no: “Uz praktisko dzīvi orientētas izpratnes veidošanās ķīmijā”. Tālākizglītības kursu materiāls ķīmijas skolotājiem. LU ĶF ķīmijas didaktikas centrs
Rediģēja un teorētisko pamatojumu pievienoja: Ilze Seglēre, Latvijas Universitāte “Dabaszinātņu un IT pedagogs”.

 Attēla avots
Attēla avots